曾经有这样一个传言,“中国的*长城是太空中能看到的地球上的人工建筑”,这让我们中国人自豪无比。但神舟载人飞船上天后,包括杨利伟、刘洋在内的众多航天员都曾说过,“没有看到长城”,这是为何呢?

长城
其实人眼的分辨率很有限,只有0.3角分左右,即便在二百公里左右的近地点轨道高度上,不考虑任何天气因素,人眼至多看清17米以上的目标,因此对于宽度不过七八米的长城,确实有心无力了。当然了,若是不考虑“看清”,而只是“看到”,那么只要在夜间将长城照的灯火通明,太空中的宇航员就有可能“看到”长城了。不过这就像远远看到商店的霓虹灯箱,却看不清楚灯箱的字一样,不属于我们此处讨论的范畴。
200公里左右太空看长城效果示意图
成像系统的分辨率之所以会受到限制,除了光学元件存在像差之外,更重要的原因是光波存在衍射效应,使得一个理想无限小的点物体发射的光波通过系统成像后,由于成像系统口径有限,物体光的高频成分被阻挡,终参与成像的只有物体光波的低频成分(因此传统成像系统本质上相当于一个低通滤波器),使得终的像不再是一个无限小的理想点,而成为了一个弥散的亮斑,称为“艾里斑”。
因此当两个点物体距离较近时,它们通过成像系统后形成的两个艾里斑就会重叠到一起无法分辨,两个物点恰能分辨的距离就是极限分辨距离,对应的张角即为极限分辨角,这就是的“瑞利判据”。科学家发现,通常情况下该极限分辨率与光的波长(λ)、成像系统口径(D)和数值孔径(NA)等参数有关。

瑞利判据
为了获得更好的成像效果,科学家尝试了许许多多的方法:在光刻系统中使用越来越短的光波(如目前因特尔等芯片企业已开始使用极紫外光),扩大成像系统口径(如天文望远镜口径已达到10米以上),增加成像系统数值孔径(如显微成像系统使用浸油等方式获得更大的NA)等,但这些方法都未能摆脱理论极限的影响。
“衍射极限”仿佛是一片笼罩在头顶的阴霾,成为了看似坚不可摧的障碍。为了能够打破这个枷锁和桎梏,实现超分辨成像,科学家们真是脑洞大开,展现出了无穷的智慧。
让我们看看科学家们通过哪些方法打破桎梏:
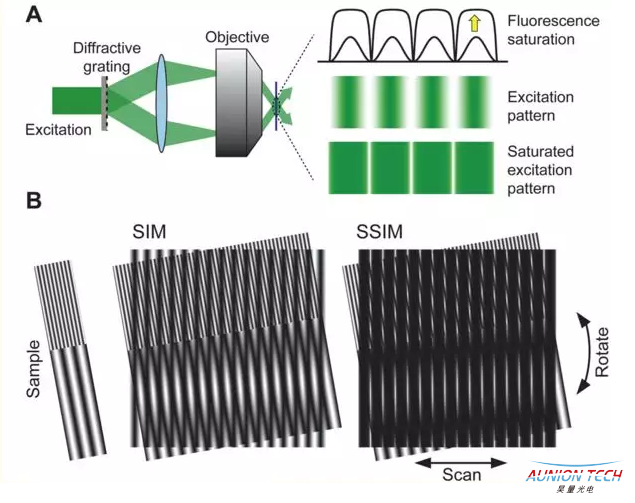
结构光照明显微(SIM)
普通光学显微镜的成像过程可以通过点扩展函数进行描述,通过对点扩展函数进行傅里叶变换,可获得显微系统的光学传递函数。由于衍射极限的存在,光学传递函数限制了通过显微系统的信息量,只允许低频信息通过系统,滤除代表细节的高频信息,即限制了系统的分辨率。
结构光照明显微镜实现超分辨的原理,就是利用特定结构的照明光 在成像过程把位于光学传递函数范围外的一部分信息转移到范围内,利用特定算法将范围内的高频信息移动到原始位置,从而扩展通过显微系统的样品频域信息,使得重构图像的分辨率超越衍射极限的限制。
对于光学显微镜系统,光学传递函数的三维结构是圆环结构,在零频位置存在凹陷。凹陷带来的后果就是CCD 上记录的信息不仅包含物镜焦平面上的样品信息,同时包含焦平面外的样品信息。由于受到焦平面外的信息的干扰,常规荧光显微镜无法获得层析图像。三维结构光照明显微镜提高分辨率、获得层析图像的原理,就是利用特定结构的照明光来获得样品的高频信息,采用特定算法在横向和纵向上扩展样品频域信息的同时弥补凹陷带来的影响。
饱和结构照明显微镜(SSIM)的原理

法国OXXIUS多波长合束激光器应用在Nikon显微镜
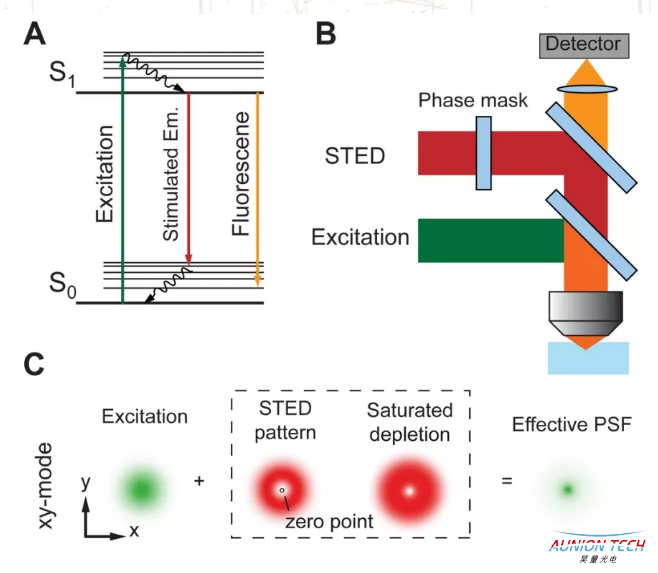
受激发射损耗显微(STED)
在STED显微术中,有效荧光发光面积的减小是通过受激发射效应来实现的。一个典型的STED显微系统中需要两束照明光,其中一束为激发光,另外一束为损耗光。当激发光的照射使得其衍射斑范围内的荧光分子被激发,其中的 电子跃迁到激发态后,损耗光使得部分处于激发光斑外围的电子以受激发射的方式回到基态,其余位于激发光斑中心的被激发电子则不受损耗光的影响,继续以自发荧光的方式回到基态。
由于在受激发射过程中所发出的荧光和自发荧光的波长及传播方向均不同,因此真正被探测器所接受到的光子均是由位于激发光斑中心部分的荧光样品通过自发荧光方式产生的。由此,有效荧光的发光面积得以减小,从而提高了系统的分辨率。STED显微术能实现超分辨的另一个关键在于受激发射与自发荧光相互竞争中的非线性效应。
当损耗光照射在激发光斑的边缘位置使得该处样品中的电子发生受激发射作用时,部分电子不可避免地仍然会以自发荧光的方式回到基态。然而当损耗光的强度超过某一阈值之后,受激发射过程将出现饱和,此时以受激发射方式回到基态的电子将占绝大多数,而以自发荧光方式回到基态的电子则可以忽略不计。因此,通过增大损耗光的强度,使得激发光斑范围内更多范围的自发荧光被抑制,可以提高STED显微术的分辨率。
受激发射损耗(STED)显微的原理

法国OXXIUS公司多波长合束激光器
STORM和PALM超分辨显微成像技术
STORM技术中,使用Cy3和Cy5分子对作为荧光标记实现超分辨成像,因为不同波长光可以控制Cy5在荧光激发态和暗态之间切换,例如红色633nm激光可以激活Cy5发射荧光,同时长时间照射可以将Cy5分子转换成暗态不发光。之后用绿色的532nm激光照射Cy5分子时,可以将其从暗态转换成荧光态,而此过程的长短依赖于第二个荧光分子Cy3和Cy5之间的距离,因此,当Cy3和Cy5交联成分子对时,具备了特定的激发光转换荧光分子发射波长的特性。
在显微观察前,首先将待测观察样品用染剂染色,将Cy3和Cy5分子对胶联到特异的蛋白质抗体上,就可以用抗体来标记细胞的内源蛋白,然后用波长为633nm的红光长时间照射样品使Cy5发射荧光后全部转化为暗态,采用波长为532nm的绿光激发Cy3,从而使Cy5处于荧光态。激发过程中应使532nm绿光强度足够低,以保证在衍射极限范围内至多只有一个Cy5荧光分子被激活至荧光态。而后,用波长为633nm的红色激光照射待观察样品,使处于荧光态的Cy5分子发射荧光。通过电子相机读取荧光图像,采用函数拟合的方法对图像进行处理,进而确定每个荧光点的中心位置。经过足够多次数循环后对获得的荧光点位置进行叠加,终得到超分辨显微图像。
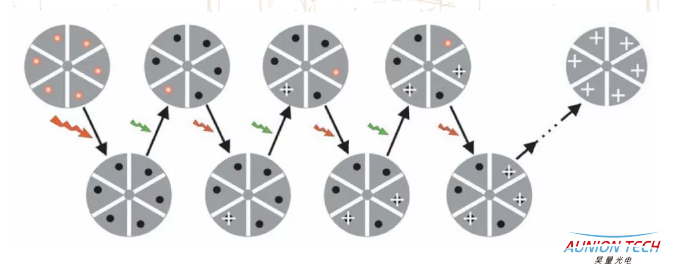
STORM技术中荧光开关原理图
PALM技术中,使用GFP突变体作为光活化蛋白(PA-GFP)来标记靶蛋白,并在细胞中表达。用405nm激光器低能量照射细胞表面,一次仅激活出稀疏分布的几个荧光分子,然后用561nm激光激发得到荧光,通过高斯拟合来定位这些荧光分子,在确定这些分子的位置后,长时间使用561nm激光来漂白这些已经定位正确的荧光分子后,使他们不能够被下一轮的激光再激活出来。
再分别用405nm和561nm激光来激活、激发和漂白其他荧光分子,多次成像后,将这些分子的荧光图像合成到一张图上,得到了比传统光学显微镜至少高10倍以上的分辨率。PALM显微镜的分辨率仅仅受限于单分子成像的定位精度,理论上来说可以达到1nm的数量级。PALM的成像方法只能用来观察外源表达的蛋白质,而对于分辨细胞内源蛋白质的定位无能为力。
STROM与PALM的基本原理一致,区别在于STORM使用的荧光开关基团是有机荧光分子对,而PALM使用的荧光开关基团是荧光蛋白分子,由于STORM具有对细胞内源性生物分子成像的优势,目前STORM在活细胞等生物体系的应用更加广泛。在空间分辨率上,STORM可以达到10-20nm,PALM可以达到20-30nm;在时间分辨率上,STORM可以达到1s,而PALM约为30s。
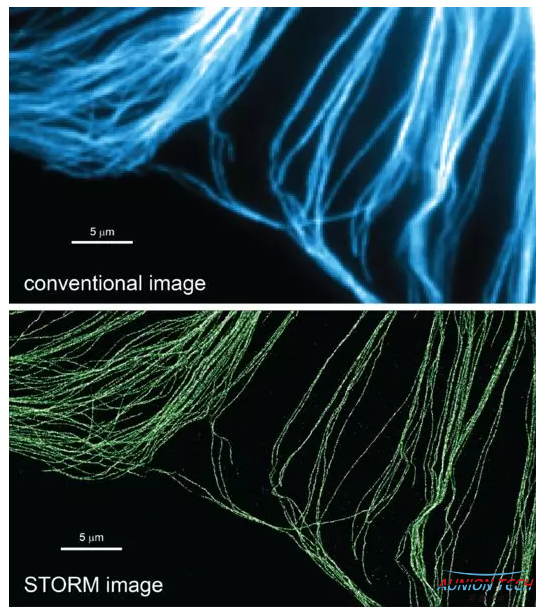
STORM与常规显微成像方法对细胞内微管成像效果对比
什么是多波长合束激光器?
合束激光器就是将多个波长光合束到一起输出,它把合束/分束、透镜、整形器件等全部集成并做了稳固性的设计,各波长独立控制。可以让科研工作者或工程师们专心于试验部分而不是做复杂的光路调节
传统合束光路
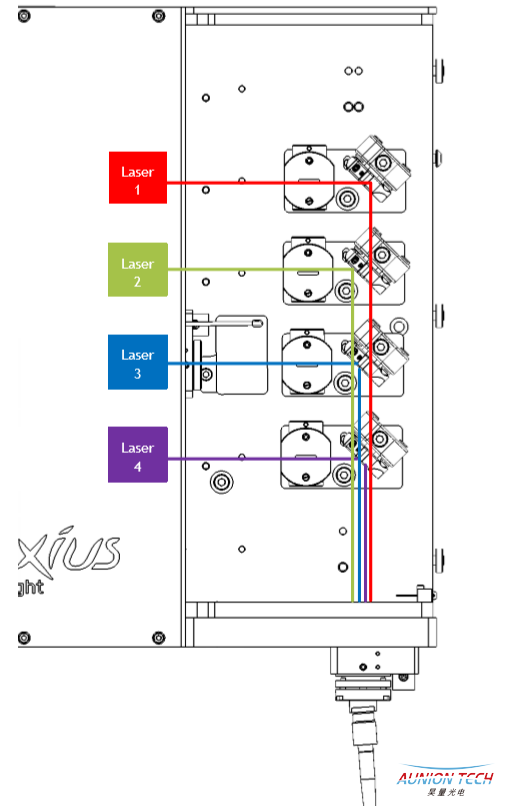
OXXIUS合束激光器内部光路设计
OXXIUS合束激光器都有啥干货?
多8波长输出~紧凑合理的尺寸~高稳定输出功率~高光束质量~高速调制功能~强大智能性….
L4Cc是一款紧凑型多波长合束激光器(通用型激光引擎),它可将35769个不同波长的激光耦合到一根单模或保偏光纤之中输出,能同时或单独对每一路激光进行控制,单波长功率可达300mW。此外OXXIUS可根据客户不同的要求进行量身定制化的服务。同时我们具有远程诊断修复和自我保护功能,同时具有通过USB和RS232接口进行软件控制。激光器可进行高速模拟调制或TTL调制。
产品特点:
客户可以自由选择合束激光的数量(09个到 35769个波长可选)
自由空间光输出/各种光纤耦合输出可选;
单光路或多光路输出
智能性强(远程诊断修复和自我保护功能);
软件控制(通过USB和RS232接口)
高稳定性,光束质量高,噪声低;
百MHZ的TTL调制功能和模拟调制;
结构紧凑,坚固耐用;
可根据客户的要求定制,不收取定制费;
高性价比;
主要应用:超分辨率成像、共聚焦显微镜、荧光激发、流式细胞仪、SPIM、FRAP、TIRF……
典型波长参数:
波长 | 405nm | 488nm | 532nm/561nm | 638nm |
输出功率 | 0-300mw | 0-200mw | 0-500mw | 0-500mw |
功率调节范围 | 0-100% | 0-100% | 0-100% | 0-100% |
模拟调制 | 3MHZ | |||
TTL调制 | 150MHZ | |||
光束质量(M^2) | <1.1 | |||
激光器尺寸 | 250mm*200mm*108mm | |||
工作电压 | 220VAC | |||
OXXIUS合束激光器家族部分解决方案:
(单光路输出) (双光路输出)

(8波长四光路输出) (6波长可插拔光纤输出)

OXXIUS公司其它激光器:


下一篇:浅析皮秒激光器的运行原理
 上海市徐汇区虹梅路2007号6号楼75楼
上海市徐汇区虹梅路2007号6号楼75楼 [email protected]
[email protected]
昊量微信在线客服

昊量微信在线客服
版权所有 © 2024上海昊量光电设备有限公司 备案号:津ICP备55480275号 技术支持: Sitemap.xml